Be yourself; Everyone else is already taken.
— Oscar Wilde.
This is the first post on my new blog. I’m just getting this new blog going, so stay tuned for more. Subscribe below to get notified when I post new updates.
Be yourself; Everyone else is already taken.
— Oscar Wilde.
This is the first post on my new blog. I’m just getting this new blog going, so stay tuned for more. Subscribe below to get notified when I post new updates.
Aunque ahora nos pueda parecer una idea irracional, hasta antes de los años 1800s el lavado de manos no era una práctica común, incluso dentro del entorno médico. No fue sino hasta 1847 cuando el médico húngaro, Ignác Philipp Semmelweis, promulga su teoría sobre el contagio de la fiebre puerperal y la mala higiene de las manos de los profesionales de salud de la época y propone el lavado de manos mandatorio con cal clorada. Esta teoría, le costaría su reputación como médico, pero ha salvado la vida de millones de personas por enfermedades fácilmente prevenibles. Semmelweis hoy en día es conocido como ¨el salvador de madres¨ ya que fue quien logró asociar la morbilidad y mortalidad de ciertas pacientes que daban a luz con quienes las atendían.
Ignác observó en el hospital donde trabajaba , el Hospital General de Viena , donde sólo habían dos salas de partos, que aquella donde atendían doctores y estudiantes de medicina tras realizar prácticas y visitas a la morgue, estaba estrechamente relacionada con la alta tasa de pacientes enfermas y fallecidas. Por otro lado, la otra sala, controlada por parteras con mejores condiciones higiénicas no tuvo tanta incidencia, por lo que el ahora considerado padre de los procedimientos antisépticos logró atar cabos y llegar a una conclusión. Supuso, que de alguna manera, ¨partículas cadavéricas¨ se adherían a las manos y eran transportadas desde la morgue hacia la sala de partos y estas eran las causantes del contagio, por lo que era necesario una higiene de manos adecuada. Sin embargo, el reconocimiento de este hecho llegaría después de su muerte, en la segunda mitad del siglo XIX, por la identificación de las “partículas cadavéricas” como microorganismos patógenos por parte de Louis Pasteur y Robert Koch.
El 15 de octubre, Día Mundial del lavado de Manos, es una celebración que se realiza desde el 2008, el cual fue elegido por la Asamblea General de las Naciones Unidas para ser el Año Internacional del Saneamiento. La finalidad de este día es la de fomentar la cultura del lavado de manos con jabón y hacer públicos sus beneficios. Estos últimos han sido comprobados desde hace muchos años por una cantidad sumamente extensa de estudios y pruebas clínicas.
Entre los beneficios del lavado de mano se encuentran:
Para maximizar la efectividad del lavado de manos se deben tomar en cuenta algunas recomendaciones, empezando con una duración de al menos 15 segundos. El usar una cantidad adecuada de jabón y abundante agua, secarse con toallas de papel desechables usando esta para cerrar la llave y evitar la exposición repetida de agua caliente por el riesgo de desarrollar dermatitis, son igualmente factores importantes para un correcto proceder.
Los pasos para una técnica correcta de lavado de manos según la Organización Mundial de la Salud son:
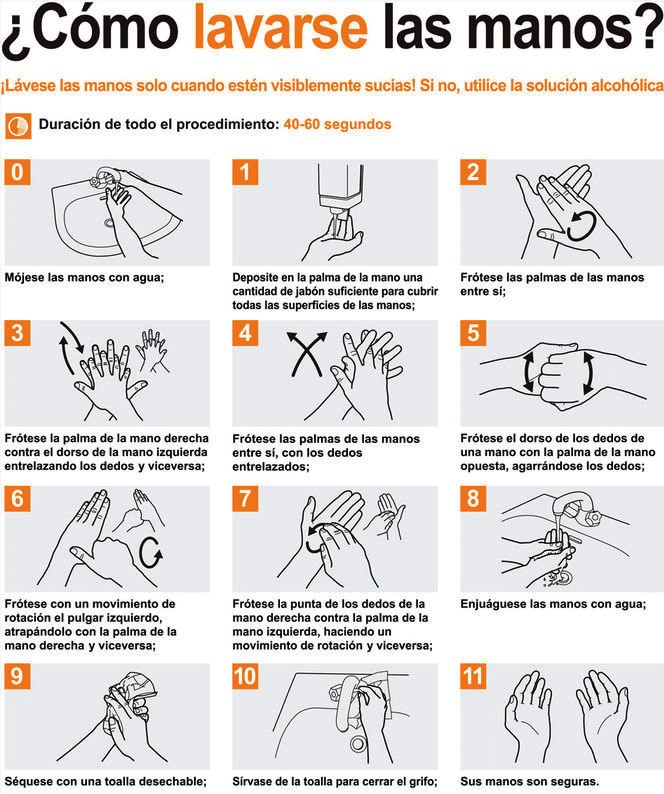
Padecer o no una enfermedad está a un simple lavado de manos de distancia. Este es el método más fácil, rápido y económico para evitar enfermedades causadas sobre todo por bacterias y parásitos. Es necesario hacer de este, más que un hábito, una necesidad constante.
En la vida cotidiana existen momentos clave que requieren de una limpieza de manos que no debemos olvidar: después de tocar a tu mascota, tras ir al baño o antes de comer. Por su parte, para los profesionales de la salud, la higiene de manos es una obligación que deben cumplir para con sus pacientes y que no puede ser omitido por ninguna circunstancia.

La responsabilidad y la conciencia que cada uno de nosotros tenga sobre la importancia del lavado de manos es vital, ya que de esa forma sabremos cuánto tiempo lavarnos, cómo aplicar el antiséptico y desde dónde debemos lavarnos. Debemos saber que no es un lavado rápido y que es una rutina forzosa e ineludible, ya que cualquier infección que se produzca es nuestra responsabilidad, y eso es muy delicado.
La duración total del procedimiento es de 3 a 5 minutos. El MINSAL considera los 5 minutos desde que se remueven las joyas y el reloj y se suben las mangas, pero en realidad, se supone que uno debe entrar al recinto quirúrgico sin joyas ni nada de eso.
El primer lavado de manos debe ser riguroso y emplear 3 a 5 minutos, pero si la persona participa en más cirugías, puede ir reduciendo el tiempo; así, en la quinta cirugía es suficiente con emplear 1 minuto, gracias al efecto residual del gluconato de clorhexidina.
Con respecto a las manos partidas o agrietadas, el MINSAL nos recuerda que favorecen la flora microbiana transitoria, por lo su cuidado es importante. El uso de lociones y cremas también esta indicado al final de la jornada, ya que esto contribuye a devolver la acidez y la humedad a las manos, que es nuestra principal herramienta de trabajo.
Cuando las manos están agrietadas, el mismo individuo debería autolimitarse y segregarse del equipo quirúrgico, porque el lavado no va a cumplir su objetivo.
En resumen, la norma del MINSAL sobre el lavado de manos quirúrgico establece que debe durar 5 minutos, de los cuales, 2 minutos son de lavado, 1 minuto es de escobillado de uñas y otros 2 minutos son para el segundo lavado, todo con enjuagues entre lavados.
Los lavados posteriores son de sólo 2 minutos y no incluyen el escobillado de uñas


CICATRIZACIÓN
La cicatrización es el proceso de sanar los tejidos lesionados por medio de una compleja cascada de eventos celulares, los cuales son coordinados por mediadores solubles y conducen a la restitución física y funcional del tejido dañado. La cicatrización va a tener tres fases principales: hemostasia e inflamación, proliferación y remodelación. La literatura marca que, para fines didácticos, el proceso lo han dividido en esas tres fases, pero en la realidad se sobrelapan y evolucionan al mismo tiempo.

PRIMERA FASE: HEMOSTASIA y FASE INFLAMATORIA:
Formación del tapón plaquetario y la malla de fibrina

La hemostasia va a inducir el proceso inflamatorio normal. La inflamación es la respuesta del organismo para poder curar y limpiar la herida, así como también la liberación de factores solubles quimiotácticos que controlan la permeabilidad de los vasos y otros que atraen o atrapan células. Primeramente, el cuerpo va a reconocer lo extraño para poder atacarlo, después los mastocitos van a liberar histamina (vasodilatador) y heparina (anticoagulante) para favorecer el proceso de inflamación. Después de esto, se va a activar el sistema de complemento, que se van a combinar para producir una gran cantidad de complejos proteínicos que median la lisis de las células bacterianas. Los factores del complemento opsonizan y hacen reconocibles a los invasores. En esta fase domina el flujo de elementos hemáticos al sitio de la lesión con la liberación de citocinas y otros mediadores de la inflamación.
Reconocimiento del agente extraño y acción del sistema inmune
Gracias a este estímulo existe el incremento en el paso de leucocitos a tejidos, con la llegada de los neutrófilos y después monocitos y macrófagos, llegando por último los linfocitos. Junto con otros leucocitos fagocitan, digieren y destruyen organismos y proteínas resultado de la muerte tisular, al mismo tiempo que liberan intermediarios y enzimas. Todos estos procesos de macrófagos y monocitos estimulan tanto la angiogénesis como la proliferación celular.

Después de que el organismo limpió y reparó el sitió de lesión con los mecanismos de hemostasia e inflamación, la proliferación se va a encargar de formar el nuevo tejido, rico en células y vasos sanguíneos, también conocido como tejido granular.
Se inicia entre los tres y cinco días después de producirse el daño tisular y dura entre cuatro y catorce días. Los fibroblastos son las células predominantes en esta fase. Los macrófagos migran desde el fondo hacia la superficie y de los extremos hacia el centro de la herida. Las células epiteliales son capaces de emigrar sobre las moléculas de colágena, y su mitosis tiene lugar bajo estímulo de factores de crecimiento epidérmico que son, además, importantes mitógenos de la proliferación celular. Las células se multiplican y movilizan hasta que entran en contacto con otras células epiteliales, momento en el cual se inhiben. Entonces las células toman una apariencia similar a la que tuvieron en condiciones basales y, a medida que maduran, forman queratina. La producción y depósito de colágenas parece ser la más importante de las funciones del fibroblasto. En la cicatrización, la función básica de la colágena es la de proveer integridad estructural y fuerza a los tejidos. También existe la formación de nuevos vasos (angiogenesis) y esto es inducido por macrófagos y monocito, para aportar O2 y nutrientes al tejido en proceso. Las células que intervienen en el proceso de angiogénesis son las endoteliales, y su actividad resulta de numerosos estímulos quimiotácticos entre los que la fibronectina, la heparina y los factores plaquetarios parecen desempeñar una función importante.

EPITALIZACIÓN.
La respuesta de las células epidérmicas inicia dentro de las primeras 24 h de sufrida la lesión. A las 12 h de perder contacto con sus homólogos vecinos, los queratinocitos de los bordes de la herida y de los folículos pilosos o de las glándulas sebáceas se aplanan, forman filamentos de actina en su citoplasma, emiten prolongaciones semejantes a seudópodos y emigran.
ANGIOGÉNESIS.
El término “angiogénesis” se utiliza para designar la pro- liferación de nuevos vasos o neovascularización, o bien, el flujo local de células endoteliales. Los monocitos y los macrófagos producen factores que inducen la formación de nuevos vasos por los que se transporta oxígeno y nu- trientes a la herida, y secretan sustancias biológicamente activas,36 estimulados por la baja tensión de oxígeno (pO2) tisular resultante de la lesión, la presencia de ácido láctico y aminas biógenas.
MATRIZ DE LA HERIDA (SUSTANCIA FUNDAMENTAL)
El tejido herido no sólo está formado por células; también es preciso considerar el espacio extracelular, el cual está lleno de macromoléculas que forman una matriz compuesta por proteínas fibrosas embebidas en gel de polisacáridos, hidratados y secretados por fibroblastos.
CONTRACCIÓN DE LA HERIDA.
La contracción de la herida es el mecanismo biológico por medio del cual las dimensiones de una herida extensa y no suturada disminuyen durante la cicatrización. Es una disminución gradual del área de la herida por retracción de la masa central del tejido de granulación.
TERCERA FASE: FASE DE REMODELACIÓN.
Cuando ha sido reparada la rotura de la continuidad de los tejidos, el estímulo angiógeno disminuye en intensidad y, al parecer, como respuesta a las tensiones elevadas de oxígeno en los tejidos se inicia un periodo en el que la herida madura, la cual presenta remodelación morfológica, también disminuyen la hiperemia y su vascularidad, asimismo se reorganiza el tejido fibroso neoformado. A esto se le llama fase de remodelación y consiste en el descenso progresivo de los materiales formados en la cicatriz, así como en los cambios que experimenta con el tiempo.
Las macromoléculas dérmicas como la fibronectina, el ácido hialurónico, los proteoglucanos y la colágena funcionan como andamio para la migración celular y soporte de los tejidos. Su degradación y remodelación forman un proceso dinámico que continúa mucho tiempo después de que se restaura la continuidad de la piel. Esta remodelación es resultado de un buen proceso de cicatrización, que va a ocurrir sin alteraciones si dejamos que está actúe de manera biológica y en su curso natural, pero pueden existir ciertas condiciones que no permitan la reconstrucción del tejido y sean cicatrizaciones patológicas.

INFECCIÓN LOCALIZADA
CELULITIS
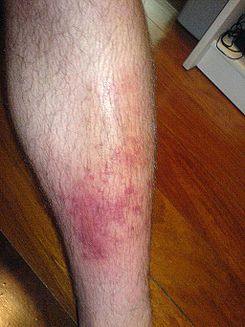
Es una inflamación no supurativa del tejido subcutáneo que se extiende en los planos de tejido conjuntivo y espacios intercelulares. Se acompaña de edema diseminado, rubor y dolor difusos. La necrosis y supuración centrales pueden ocurrir en etapas tardías, en infecciones graves se forman vesículas en la piel. Los agentes causales más frecuentes son los estreptococos hemolíticos, responden al tratamiento con penicilina y reposo, si la inflamación no cede en 48 a 72 hrs. de antibioticoterapia, apunta a la formación de un absceso, en cuyo caso requiere incisión y drenaje.
ABSCESO
Es la acumulación localizada de pus, rodeada por un área de tejido inflamatorio en que son intensas la hiperemia e infiltración leucocitaria. Exteriormente se puede visualizar como una zona tumoral o vultuosa, pudiendo o no tener, edema de piel y tejido celular. En algunos casos presenta rubor intenso de la piel que lo recubre, que puede además tener el aspecto de piel de naranja por alteración del drenaje linfático superficial.
FOLICULITIS
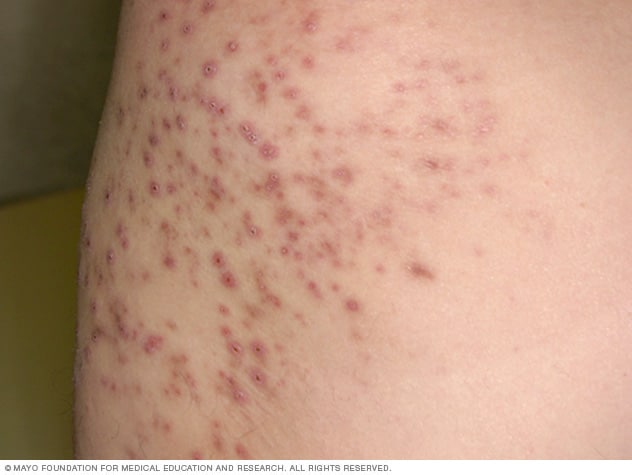
La foliculitis es la infección de un folículo pilosebáceo con la formación de un pequeño absceso que sólo requiere medidas higiénicas y, quizá, la aplicación de sustancias antisépticas en forma local mientras involuciona.
FURÚNCULO
Cuando la infección de los folículos abarca la dermis Subyacente, la reacción inflamatoria es de mayores dimensiones. Forma un absceso, el que puede acompañarse de fiebre y afectar el estado general.

INFECCIONES DE RAPIDA INVASIÓN.
ERISIPELA Y LINFANGITIS
Cuando el agente infectante produce enzimas proteolíticas que destruyen los cementos intercelulares, la infección no forma el pus de alto contenido leucocitario ni se forma una
membrana fibroplásica protectora, más bien, se produce una infección superficial de rápido avance para la cual los griegos usaron el nombre de erisipela, misma que se expande en los tejidos causando celulitis e inflamación difusas, en ocasiones incontrolables, que rebasan los mecanismos de defensa y ascienden con rapidez por los trayectos de los vasos linfáticos, y tienen el aspecto de una flama roja ascendente que recibe el nombre de linfangitis.
INFECCIÓN NECROSANTE
La necrosis infecciosa de los tejidos puede afectar las fascias musculares y los músculos esqueléticos. La terminología que se utiliza para denominar estas infecciones ha llegado a ser muy confusa porque tiene muchos epónimos que corresponden a los diferentes lugares donde se puede observar. Por otra parte, la causa bacteriológica no es siempre la misma e, incluso, pueden ser infecciones polimicrobianas o sinérgicas.
FLEMONES
La mayoría de los autores está de acuerdo en llamar flemones a las infecciones profundas rápidamente invasivas, no limitadas y que afectan los planos blandos, donde causan necrosis con poca formación de pus.
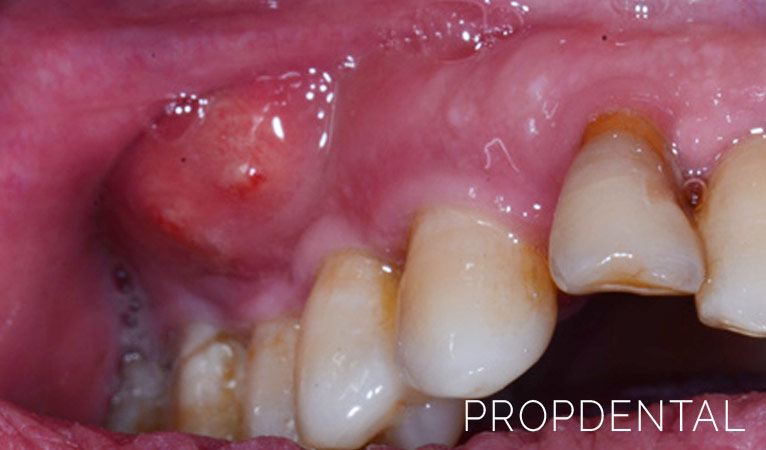
MIOSITIS NECROSANTE
Los padecimientos quirúrgicos son resultado de traumatismo con lesiones de los planos blandos infectados, sobre todo por gérmenes residentes o transitorios que invaden los tejidos expuestos.
Son muchas las enfermedades que pueden predisponer a las personas a la fascitis necrosante, pero se deben mencionar entre las más frecuentes los estados de depresión del sistema inmunitario (diabetes mellitus, alcoholismo, enfermedad neoplásica); trastornos circulatorios que
comprometan la circulación local, así como el inóculo bacteriano con anaerobios o anaerobios facultativos.
INFECCIONES INTRAABDOMINALES
La infección por contaminación de la cavidad peritoneal se conoce como peritonitis o infección microbiana intraabdominal y, de acuerdo con la clasificación etiológica de Schwartz, se cataloga como: 1) primaria cuando es ocasionada por inoculación, sea directa o por vía hematógena en los pacientes que tienen gran cantidad de líquido peritoneal por ascitis o por los catéteres intraperitoneales que se usan en la diálisis ambulatoria de los enfermos renales; y 2) secundaria, cuando es resultado de una perforación visceral o inflamación de los órganos intraabdominales.
La diferencia estriba en que en el primer caso se está frente a una infección monomicrobiana que rara vez requiere intervención quirúrgica y su tratamiento consiste en el uso de antibióticos específicos contra el organismo cultivado por espacio de 14 a 21 días, en tanto que en el segundo caso se trata de infecciones sinérgicas con múltiples especies de bacterias aerobias y anaerobias que actúan en conjunto.
INFECCIONES EN FARMACODEPENDIENTES
La inyección de drogas ilícitas es una práctica cuya frecuencia aumenta en la sociedad actual y hasta el momento es imposible determinar su importancia epidemiológica porque los farmacodependientes son una población oculta en quienes la mortalidad es más elevada que en la población sana. Se sabe que la infección parece ser una de las causas finales de la muerte.
Todas las condiciones para la transmisión de padecimientos infecciosos, incluso el SIDA, y se introducen inóculos virales, bacteriológicos y parasitarios que pueden producir infecciones locales y hematógenas.

INFECCIONES POR MORDEDURAS Y RASGUÑOS
Las heridas por mordeduras y rasguños de animales o de seres humanos son inoculadas con microorganismos que atraviesan la barrera tegumentaria y llegan a los planos
susceptibles. Los organismos de las infecciones por mordedura son muy variados porque comprenden la flora bucofaríngea del animal agresor, los organismos del suelo, los microorganismos de la piel del animal y de la víctima y, a menudo, los que están presentes en las heces del animal.
MORDEDURA DE PERRO
Tienen flora mixta constituida por Streptococcus α hemolítico, Staphylococcus spp., Pasteurella multocida, Eikenella corrodens y Capnocytophaga canimorsus y, además, Actinomyces, Fusobacterium, Prevotella y Porphyromonas.
Ocasionan:
Pero algunos de los patógenos implicados son capaces de causar infección sistémica, como:
MORDEDURA DE FELINO.
Son menos comunes que las de canes, pero sus rasguños con mucha frecuencia resultan en infección. Sobre todo en los niños, las mordeduras pueden penetrar a más profundidad y ocasionar infecciones de los huesos o las articulaciones. En la infección por mordedura de gato se encuentra con frecuencia, además de la flora múltiple, Pasteurella multocida, un cocobacilo gramnegativo. El gato también puede inocular rabia y tétanos.
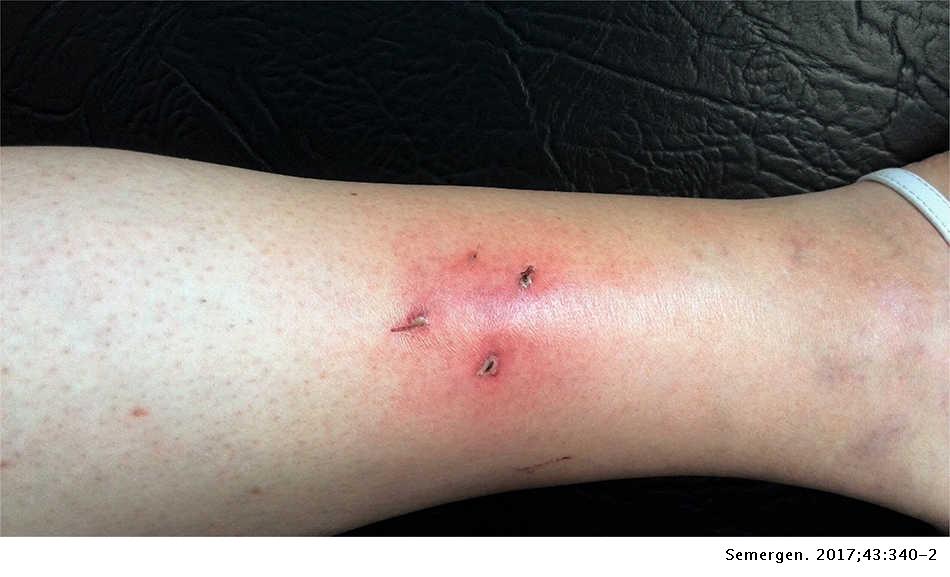
MORDEDURA POR RATA O PEQUEÑOS ROEDORES.
Pueden transmitir Streptobacillus moniliformis, que es un gramnegativo microaerófilo, y Spirillum minor, una espiroqueta que puede causar una enfermedad conocida como fiebre por mordedura de rata. La fiebre estreptobacilar se presenta de 3 a 10 días después de que la mordedura ha cicatrizado, y se caracteriza por malestar general, escalofrío, dolores musculares, cefalea y, después, aparecen manchas y pápulas en las plantas de los pies y palmas de las manos. Puede complicarse con endocarditis, miocarditis, meningitis,
neumonía y abscesos en diversos órganos.
MORDEDURA DE HUMANO.
Las heridas por contusión de la dentadura con las salientes óseas de las manos pueden ser de manera particular graves, ya que suelen alcanzar tanto las articulaciones como las vainas tendinosas, las cuales al movilizarse contaminan los tendones que se deslizan bajo la superficie de la piel.
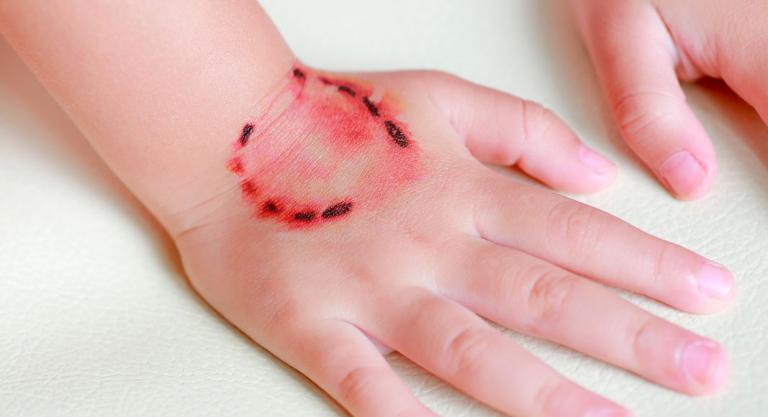
INFECCIONES EN QUEMADURA.
Las quemaduras producen interrupciones extensas de la barrera tegumentaria, con lo cual se permite la entrada de la flora propia del paciente y del hospital donde se atiende.
Se llama escara al tejido desorganizado y muerto por la acción de la agresión térmica y que proporciona un medio en el que se multiplican las bacterias que exponen a los tejidos cercanos a la infección local o sistémica.
BACTEREMIA Y SEPTICEMIA
El término “bacteriemia” indica presencia de bacterias en la circulación sanguínea, pero cuando se complica con manifestaciones de infección sistémica se utiliza el término “septicemia”.
La invasión bacteriana del torrente sanguíneo presupone que han sido vencidos los mecanismos defensivos contra la invasión bacteriana y desde luego que se asocia con un elevado porcentaje de mortalidad en las personas afectadas a pesar del tratamiento enérgico con medicamentos antibióticos. Algunos autores señalan una mortalidad de 25 a 50%.

INFECCIONES NOSOCOMIALES
Las infecciones nosocomiales son definidas como infecciones adquiridas durante la hospitalización o como resultado de ella. Cuando en un paciente que ha estado hospitalizado menos de 48 horas se desarrolla infección, se considera que ya la portaba en estado de incubación antes dé su ingreso; en tanto que la infección que se desarrolla 48 a 72 horas después del ingreso se cataloga como adquirida en el hospital. La infección quirúrgica que se manifiesta después del egreso es un ejemplo de infección nosocomial.

Asepsia y antisepsia
La asepsia hace referencia a la utilización de procedimientos que impidan el acceso de microorganismos patógenos a un medio libre de ellos, por ejemplo mediante el lavado de manos, la instauración de técnicas de barrera o la limpieza habitual. Antisepsia es el conjunto de procedimientos o actividades destinados a inhibir o destruir los microorganismos potencialmente patógenos. Para la implementación de la antisepsia se usan los biocidas, tanto en piel y tejido humanos (antisépticos) como en objetos, superficies o ambiente (desinfectantes).
Antisépticos
Alcoholes
Su mecanismo de acción corresponde a la desnaturalización de las proteínas. Tienen buena acción contra las formas vegetativas de las bacterias Gram + y – , bacilo tuberculoso, hongos y virus, hepatitis B y VIH. Su aplicación en la piel es segura y no presenta efectos adversos, solo sequedad de la piel en algunos casos de uso de formulaciones no cosméticas.
Es de rápida acción, incluso desde los 15 segundos. Aunque no tiene efecto químico de persistencia sus efectos biológicos de daño microbiano permanece por varias horas.

Tintura de yodo
Su acción se produce por oxidación e inactivación de los componentes celulares. Su uso es relativamente seguro y su acción es rápida, pudiendo mantener el efecto hasta 2 horas. Tiene un amplio espectro de acción, su concentración habitual de uso es entre 1 a 2% de yodo y yoduro de potasio en 70% de alcohol.
Tiene como principal desventaja la irritación de la piel y quemaduras de tipo química, especialmente cuando se deja por muchas horas en la piel sin retirar el producto. Su uso masivo responde a la facilidad de su preparación y bajo costo. Se utiliza por muchos años para la preparación de la piel antes de la cirugía y en menor frecuencia previo a las punciones.

Povidona yodada
Es un compuesto soluble en agua que resulta de la combinación del yodo y polivinyilpyrrolidona con lo cual se mejora la solubilidad del yodo y permite su liberación en forma gradual a los tejidos. Este efecto determina una menor irritación de la piel y una mayor disponibilidad del producto en el tiempo. En relación a la tintura de yodo o lugol, presenta menor irritación dérmica.
Se deben usar con precaución en los recién nacidos y quemados. Su acción antiséptica se clasifica entre nivel alto y nivel intermedio. Son letales en minutos para las bacterias, hongos, virus, protozoos, quistes amebas y esporas. Sin embargo, frente a esporas secas requiere de un mayor tiempo de exposición (horas). Los antisépticos yodados tienen la ventaja de ser baratos.

Clorhexidina
Su acción está determinada por daño a la membrana celular y precipitación del citoplasma. Posee un amplio espectro de acción, actúa sobre bacterias, gram + y gram -, no tiene acción sobre el bacilo tuberculoso y débil en hongos. Su acción antiviral incluye VIH, herpes simplex, citomegalovirus e influenza. De acción germicida rápida y su duración prolongada gracias a que esta sustancia tiene gran adhesividad a la piel, tiene un buen índice terapéutico. Su uso es seguro incluso en la piel de los recién nacidos y la absorción a través de la piel es mínima. Solamente se ha reportado toxicidad en instilaciones de oído medio y ojos.
Su acción se puede ver afectada por surfactantes no iónicos o aniones inorgánicos presentes en el agua dura y componentes utilizados en su preparación. Las formulaciones mas comunes son al 2% y 4%.

Triclosán
Es un derivado fenólico relativamente nuevo que actúa produciendo daño en la pared celular de los microorganismos. Es de amplio espectro bacteriano, mejor para Gram + y hay poca información sobre su actividad en virus. Es absorbido por la piel intacta lo cual determina su persistencia y su rapidez de acción es intermedia. No se ha demostrado efecto alergénico ni mutagénico en períodos cortos de uso. Su actividad es mínimamente afectada por la materia orgánica.
Las concentraciones de uso habitual son entre 0,3% y 2%. Se indica principalmente para el lavado de manos de tipo clínico donde se utiliza en panes al 1% y en preparaciones líquidas al 0,5%.

¿Qué es la desinfección?
La destrucción de los gérmenes causantes de enfermedad por aplicación directa de agentes químicos o físicos sobre objetos inanimados, como instrumentos, pisos y paredes, entre otros. La mayoría de los biocidas pueden actuar como antisépticos, aplicados sobre piel y tejidos, o desinfectantes, sobre materiales inanimados. El espectro de acción de los germicidas depende de las características propias del producto y de factores externos controlables: temperatura, concentración, tiempo de exposición, etc.
¿Qué es la esterilización?
Las técnicas de esterilización son fundamentalmente de carácter físico, a través de autoclaves que exponen el material a vapor o gas esterilizante. Los mayores avances están en las exposiciones a bajas temperaturas con tiempos más cortos de exposición, en paralelo con los avances tecnológicos de instrumentación con materiales que no soportan temperaturas elevadas y con rotaciones de uso altas, por la presión asistencial.
Esterilización por métodos físicos
CALOR EN SECO
La elevación de la temperatura hasta alcanzar niveles incompatibles con la vida es el mecanismo más antiguo de esterilización; sin embargo, tiene el inconveniente de que deteriora los objetos que se desean esterilizar, y su uso se limita a artículos que se han de eliminar o a cristalería y materiales que toleran temperaturas muy altas. Este tipo de esterilización es de uso común en los laboratorios de microbiología e investigación.

Flama directa
Aún se utiliza el mechero de Bunsen (Robert Bunsen, 1855) con algunas modificaciones hechas por Meker y Fisher. Este quemador consume gas butano y aire para producir una flama que en su porción alta alcanza temperaturas hasta de 1 500 °C. Las asas de platino del laboratorio de microbiología se esterilizan al exponerlas a la flama directa; el procedimiento es confiable para la manipulación de cultivos y siembras en medios de cultivo. No se aplica en cirugía porque deteriora los instrumentos.

Incineración
Tiene utilidad cuando al mismo tiempo que se desea destruir a los gérmenes se pretende eliminar el material séptico o contaminado. Es una forma rápida y eficaz de eliminar fómites (sustancias u objetos no alimenticios que pueden transmitir o contagiar enfermedades) que sean susceptibles de combustión, así como de cuerpos de animales de experimentación, entre otros.

Hornos y estufas
La estufa consiste en una cámara dotada de un elemento calefactor, por lo general de resistencias eléctricas. Por ser el aire un mal conductor del calor, se permite que penetre poco a poco durante la esterilización, ya que el horno está dispuesto de tal manera que favorezca la circulación del mismo mediante el uso de ventiladores que lo impelen a velocidad elevada con flujo horizontal para uniformar las temperaturas interiores que alcanzan hasta 250 °C. Tiene un termostato de seguridad para limitar el incremento a no más de 300 °C.

CALOR HÚMEDO
Cuando al calor se le agrega humedad, las proteínas se desnaturalizan sin necesidad de alcanzar temperaturas muy altas, y de este modo se hace más corto el tiempo de exposición. Aunque algunas esporas son capaces de resistir al calor húmedo hasta temperaturas superiores a los 100 °C, el calor húmedo como agente destructor de microbios se emplea en diversas formas.

Tindalización
Es un método en el que se utiliza calentamiento intermitente de líquidos. Se emplea para esterilizar medios de cultivo, azúcares y gelatinas; se basa en el principio de que un primer calentamiento destruye las formas bacterianas vegetativas y las formas de resistencia que sobreviven germinarán por estar en un medio favorable; sin embargo, serán destruidas en calentamientos sucesivos. La exposición es a 100 °C durante 20 minutos por tres días consecutivos. Este procedimiento toma su nombre del físico inglés John Tyndall y tiene uso en los laboratorios de microbiología.
Calor húmedo bajo presión (autoclave)
La esterilización con autoclave de vapor es el procedimiento más práctico y difundido. los factores temperatura, humedad y tiempo son los que producen la desnaturalización de las proteínas; la presión es necesaria para elevar con mayor rapidez la temperatura del vapor. El autoclave produce una esterilización muy efectiva, tiene bajo costo y el proceso es fácil de controlar. Además de esterilizar los instrumentos quirúrgicos es capaz de esterilizar la ropa y los objetos de hule, los cuales al final están secos, con deterioro mínimo y sin residuos tóxicos. También es útil para esterilizar líquidos.

Las heridas son el resultado de una rotura de la superficie de la piel, causada muchas veces por un objeto cortante. Las lesiones tisulares se reparan mediante el recambio del tejido lesionado. Si la pérdida de tejido es poco importante, suele bastar con aproximar los bordes de la herida, pero si la pérdida de tejido es considerable la curación se prolonga durante mucho más tiempo.
Las heridas son causadas por cortes, desgarros, quemaduras y aplastamientos de la piel. También pueden ser consecuencia del calor y del enfriamiento. El calor excesivo desnaturaliza las proteínas y el enfriamiento por debajo de los cero grados produce formación de cristales en el interior de las células. También son causa de heridas las corrientes eléctricas intensas, la agresión química y la interrupción del aporte sanguíneo. Es importante conocer la causa de la herida para establecer el tratamiento más adecuado y el tiempo previsto de cicatrización.
Las heridas se clasifican según su extensión, localización, profundidad, gravedad, pronóstico y agente causal.
Aquellas causadas por un objeto de borde filoso (como un cuchillo) o de extremidad aguda (como un clavo o punzón).

Son ocasionadas cuando un objeto plano o de bordes redondeados golpea los tejidos blandos o cuando el cuerpo del individuo es proyectado con cierta velocidad sobre superficies planas.

Los proyectiles acelerados por armas de fuego ocasionan lesiones complejas que difieren según las características del arma y de los propios proyectiles.
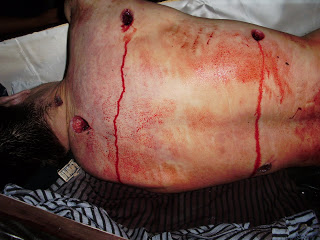
Resultan cuando los tejidos son comprimidos entre dos superficies.
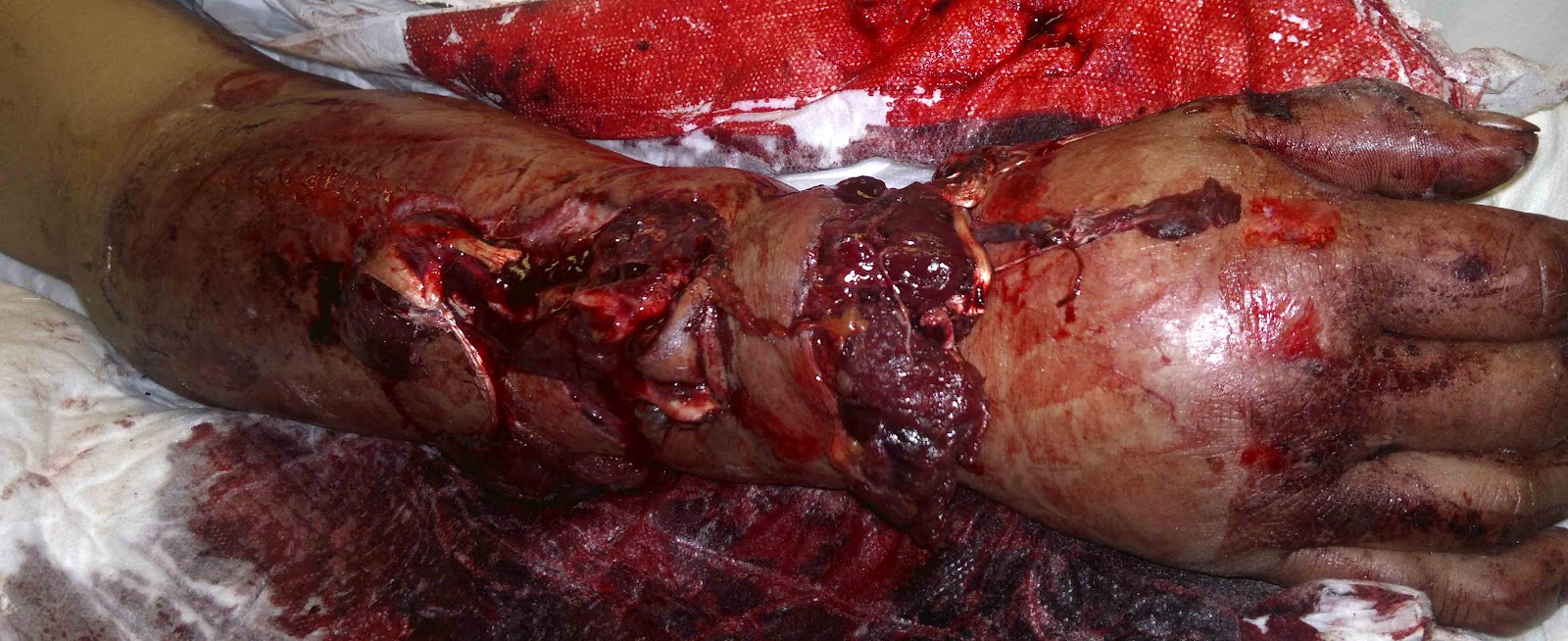
Estas heridas se producen cuando los tejidos son arrancados.

Difieren en sus características y dependen de la especie animal que las produce. Entre las más comunes están las ocasionadas por otro humano, las cuales suelen inocularse con flora bacteriana múltiple; las mordeduras por cánidos suelen recibir cuidado especial por la posible transmisión del virus rábico. Las mordeduras por animales venenosos producen agresiones biológicas complejas.

Lesión superficial que afecta la epidermis y en general cicatriza regenerando en forma íntegra el epitelio, sin dejar huella visible.

Es aquella que involucra a la piel y al tejido adiposo hasta la aponeurosis.

Afecta los planos superficiales, la aponeurosis, el músculo y puede lesionar vasos, nervios y tendones.

Herida que lesiona los planos superficiales y llega al interior de las grandes cavidades, se les llama penetrante al abdomen, penetrante al tórax y penetrante al cráneo. En ocasiones hay dobles penetrantes, por ejemplo, al tórax y al abdomen.

Es la herida donde no hay contaminación exógena ni endógena, y en la que se supone que no habrá infección.

Es una herida en la cual el cirujano sospecha que puede haber sufrido contaminación bacteriana, como donde hubo alguna violación de la técnica estéril del quirófano, o un tiempo quirúrgico controlado en que se debió abrir el tubo digestivo, la vía biliar o el aparato urinario.

En este tipo de heridas se produjo una contaminación evidente, pero no están inflamadas ni tienen material purulento.

Es la herida que tiene franca infección evolutiva, por ejemplo, las que son resultado de un traumatismo con más de 12 h de haber sucedido, o la presencia de una fuente séptica muy bien identificada.

No se suturan o sólo se unen de manera parcial para permitir la libre salida de los detritos y del material purulento, y se espera su cierre más tarde o en lo que se llama segunda intención.
Los sentidos del gusto y del olfato permiten distinguir alimen- tos indeseables o incluso mortales de otros placenteros y nutritivos. El sentido del gusto depende, principalmente, de las yemas gustativas, pero el del olfato contribuye sustancial- mente a la percepción del gusto. La textura de los alimentos, detectada por los receptores táctiles de la boca, también fomenta la experiencia del gusto.
Sensaciones gustativas primarias
En estos momentos se conocen receptores para al menos 13 sustancias químicas, que son los siguientes:
Receptores para el sodio, Receptores para el potasio, Receptores para el cloruro, Receptores para la adenosina, receptores para los iones hidrógeno, receptores para la inosina, receptores para el sabor dulce, receptores para el sabor amargo, receptores para el glutamato.
A efectos prácticos, la actividad de estos receptores ha agrupado cinco categorías, denominadas sensaciones gustativas primarías, que son agrio, salado, dulce, amargo y umami.

• El sabor agrio se debe a las sustancias ácidas y la intensidad del gusto es proporcional al logaritmo de la concentración de iones hidrógeno.
• El sabor salado se atribuye, principalmente, a los cationes de las sales ionizadas, aunque algunas sales también activan otros receptores, lo que explica la ligera diferencia entre los alimentos de sabor salado.
• El sabor dulce es el resultado de la activación de diversos tipos de receptores, para azúcares, glicoles, alcoholes, aldehídos y otros compuestos orgánicos.
• El sabor amargo también se debe a la activación de varios receptores asociados a compuestos químicos orgánicos. Las sustancias más habituales son sustancias hidrogenadas de cadena larga y alcaloides. Este grupo abarca sustancias medicinales como la quinina, la cafeína, la estricnina y la nicotina. El sabor fuertemente amargo produce, a menudo, un rechazo, que se debe al hecho de que las toxinas peli- grosas de ciertos vegetales sean alcaloides.
• Umami es una palabra japonesa que significa delicioso, constituye la quinta categoría y el sabor dominante de los alimentos que contienen L-glutamato, como los extractos cárnicos y el queso curado.
Umbral gustativo
Para reconocer una sustancia como salada, basta con que su concentración alcance 0,01 M, mientras que para percibir la quinina como amarga, su concentración solo necesita llegar a 0,000008 M. Esto se debe a la noción de que el sabor amargo cumple una función protectora frente a los alcaloides peligro- sos; por tanto, la sensibilidad es alta. Algunas personas carecen de gusto para ciertas sustancias, probablemente por una variación normal en la presencia o en el número de ciertos tipos de receptores.
Yemas gustativas y su función (p. 646)
La yema gustativa se compone de unas 50 células epiteliales modificadas, algunas de las cuales, las células de sostén, cumplen una función de soporte, mientras que otras son células receptoras verdaderas. Estas últimas son renovadas constantemente por las células epiteliales vecinas a través de la división mitótica. La vida de una célula gustativa de los mamíferos inferiores se aproximada a 10 días, y la de los seres humanos se desconoce. Las superficies apicales de las células gustativas se disponen alrededor de un poro gustativo. Las microvellosidades o cilios gustativos sobresalen del polo y constituyen la superficie receptora para las moléculas gustativas. Entre los cuerpos celulares se entrelazan fibras nerviosas sensitivas, que forman los elementos postsinápticos y responden a la actividad de las células gustativas.

Las 3.000 a 10.000 yemas gustativas del adulto se relacionan con tres tipos de papilas linguales. Las papilas fungiformes se encuentran en los dos tercios anteriores de la lengua, las papilas caliciformes forman una V en el tercio posterior de la lengua, y las papilas foliáceas se sitúan en los bordes laterales. En el paladar, las amígdalas y la epiglotis, así como en la porción proximal del esófago, existe un pequeño número de yemas gustativas. Cada yema gustativa responde, de forma característica, a solo uno de los cinco sabores primarios; la excepción ocurre cuando se ofrece una concentración muy alta de la sustancia, que puede estimular mas de un receptor diferente.
Las células gustativas. como otros receptores, producen un potencial de receptor. La aplicación de la sustancia, a la que es sensible la célula gustativa, hace que esta se despolarice, y el grado de despolarización se correlaciona con la concentración de esa sustancia. La unión de una sustancia gustativa a su receptor abre los canales iónicos específicos que facilitan la entrada de sodio dentro de la célula. La sustancia gustativa induce una respuesta rápida en las fibras sensitivas asociadas, que se adaptan a valores más bajos a los pocos segundos. Después, la sustancia gustativa es eliminada del receptor por la saliva.
Transmisión de las señales gustativas en el sistema nervioso central
Las fibras gustativas de los dos tercios anteriores de la lengua viajan primero por las ramas del nervio trigémino y se unen después a la cuerda del tímpano, rama del nervio facial. Las sensaciones gustativas del tercio posterior de la lengua son canalizadas por fibras del nervio glosofaríngeo, mientras que las posibles fibras gustativas de la epiglotis o de otras zonas discurren por ramas del nervio vago. A partir de su entrada en el tronco del encéfalo, todas las fibras gustativas pasan por el tracto solitario y acaban haciendo sinapsis en la parte rostral del núcleo del tracto solitario. Desde aquí, los axones discurren en sentido rostral, por vías mal definidas, hasta alcanzar el núcleo ventromedial del tálamo y después la corteza cerebral, en concreto la región ventral de la circunvolución poscentral, que se gira hasta la cisura de Silvia.
Además de la vía cortical para la percepción del gusto, los reflejos gustativos dependen de fibras que discurren directa- mente desde el tracto solitario hasta los núcleos salivales superior e inferior, que contienen neuronas parasimpáticas preganglionares para la activación final de la secreción de saliva por las glándulas submandibular, sublingual y parótida. Si bien algunas de estas cualidades adaptativas del gusto son consecuencia de la actividad de los receptores, la mayor parte de la adaptación ocurre a través de mecanismos centrales que no se encuentran todavía aclarados.
Sentido del olfato
El sentido del olfato humano posiblemente sea el peor conocido, posiblemente porque se trata de un fenómeno muy subjetivo. Si se compara con el de algunos animales, el olfato humano está poco desarrollado.
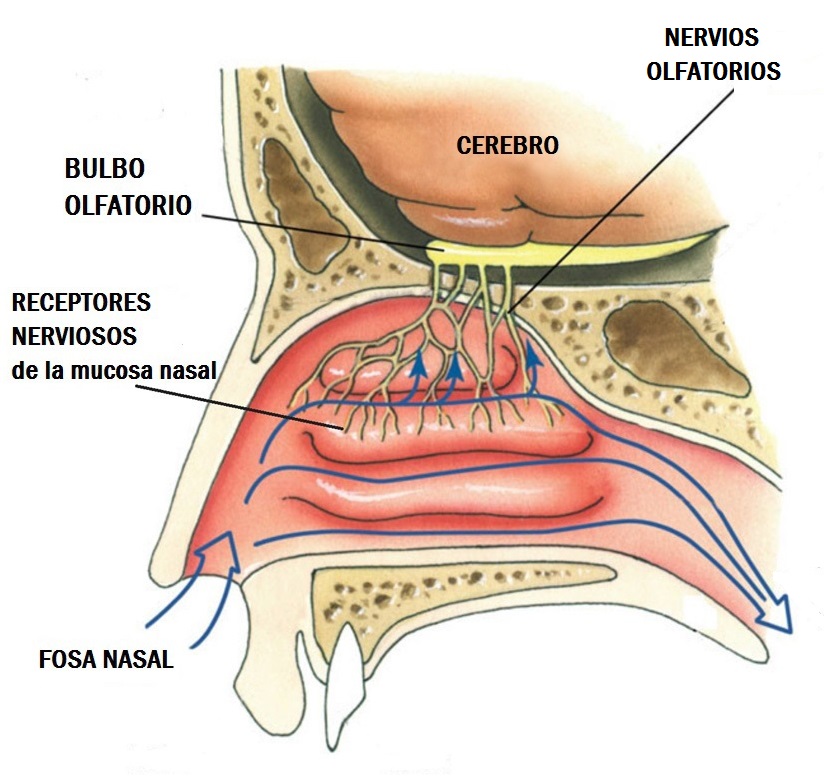
Membrana olfatoria
La superficie receptora del olfato se encuentra en la parte superior de la cavidad nasal y habitualmente se extiende solo 2,4 cm. Las células olfatorias son neuronas bipolares deriva- das del sistema nervioso central. Cada persona cuenta con cerca de 100 millones de estas células, entremezcladas con un número mucho menor de células de sostén. La superficie apical de la célula receptora muestra un botón que emite de 4 a 25 cilios olfatorios, que contienen los receptores, y se proyecta al moco presente en la superficie epitelial. Las glándulas de Bowman, que segregan el moco a la superficie epitelial, se espacian por las células receptoras.
Estimulación de las células olfatorias
Las moléculas olorosas difunden hacia el moco y se adhieren a las proteínas receptoras unidas a la proteína G citoplásmica. Con la activación se desprende la subunidad a de la proteína G que activa la adenilatociclasa, la cual da lugar, a su vez, al monofosfato de adenosina cíclico (AMPc). A continuación, el AMPc activa los canales de sodio y entran iones sodio en la célula, despolarizándola y generando potenciales de acción en las fibras sensitivas olfatorias. Esta despolarización multiplica el efecto excitador de una molécula poco olorosa y potencia notablemente la sensibilidad del sistema.
Como el sistema gustativo, la intensidad de la estimulacion, olfatoria es proporcional al logaritmo de la concentración del estímulo. Los receptores se adaptan en un 50% durante el primer segundo y luego solo lo hacen de forma mínima y lenta. Aunque casi todos los olores acaben adaptándose hasta su extinción en uno o dos minutos, este no · es un fenómeno fisiológico que ocurra en el receptor, sino que más bien depende de mecanismos centrales que modifican la percepción, lo que podría correlacionarse con el elevado número de células centrífugas que discurren desde las regiones olfatorias del encéfalo hasta el bulbo olfatorio.

Indagación de las sensaciones olfatorias primarias
Se han descrito hasta 100 sensaciones olorosas, reducidas a siete olores primarios: alcanforado, almizcleño} floral, mento- lado, etéreo} acre y pútrido.
El olfato, aún más que el gusto, se asocia a cualidades afectivas agradables o desagradables. El umbral de algunas moléculas olorosas es extraordinariamente bajo, del orden de 0,04 milmillonésimas de miligramo. Sin embargo, el inter- valo de sensibilidad solo representa de 10 a 50 veces el valor umbral, cifra relativamente baja en comparación con otros sistemas sensitivos .
Transmisión de Las señales olfatorias en el sistema nervioso central

El bulbo olfatorio se sitúa sobre la lámina cribosa del etmoides, que separa las cavidades craneal y nasal. Los nervios olfatorios atraviesan las perforaciones de la lámina cribiforrne y entran en el bulbo olfatorio, en los glornérulos, es decir, en ovillos de dendritas de células mitrales y en penacho y fibras nerviosas olfatorias. Los axones de las células mitrales y en penacho salen del bulbo olfatorio por el tracto olfatorio y entran en regiones especializadas de la corteza sin hacer relevo en el tálamo.
El área olfatoria medial está representada por los núcleos septales, que se proyectan al hipotálamo y otras regiones que regulan la conducta. Se cree que este sistema interviene en funciones primitivas, como lamerse los labios, salivar y otros comportamientos alimentarios.
El área olfatoria lateral se compone de las regiones pre- piriforme, piriforme y cortical de los núcleos amigdalinas. Desde aquí, las señales se dirigen a las estructuras límbicas menos primitivas, como el hipocampo. Al parecer, este es el sistema que asocia determinados olores con ciertas respuestas conductuales. Otra vía de filogenia más reciente se proyecta al núcleo dorsomedial del tálamo y luego a la corteza orbitofrontal.
Las fibras que se originan en el cerebro discurren de forma centrífuga hasta las células granulares del bulbo olfatorio. Estas últimas inhiben las neuronas mitrales y en penacho del bulbo, con lo que se agudiza la capacidad para distinguir los diferentes olores.
Conducción del sonido desde la membrana timpánica hasta la coclea

La membrana timpánica tiene forma cónica. En su centro se inserta el mango del martillo, que es el primero de una serie de huesecillos que componen una cadena. El yunque se inserta en el martillo a través de ligamentos, por lo que ambos huesecillos se mueven conjuntamente cuando la membrana timpánica desplaza el martillo. En el otro extremo, el yunque se articula con el estribo que, a su vez, descansa en la ventana oval del laberinto membranoso. El martillo también se inserta en el músculo tensor del tímpano, que mantiene tensa esta estructura.
El ajuste de la impedancia entre las ondas sonoras del aire y las del líquido coclear está mediado por la cadena de huesecillos. La amplitud de movimientos del estribo en la ventana oval solo representa tres cuartas partes del movimiento del mango del martillo. La cadena de huesecillos no amplifica las ondas sonoras, incrementando el movimiento del estribo, como habitualmente se cree; al contrario, el sistema incrementa la fuerza del movimiento alrededor de 1,3 veces. Como el aire de la membrana timpánica es tan grande, con relación a la superficie de la ventana oval (55 mm2 frente a 3,2 mm»), el sistema de palanca multiplica por 22 la presión que la onda sonora ejerce sobre la membrana timpánica. El líquido del laberinto membranoso posee mucha más inercia que el aire. La amplificación de la presión por la cadena de huesecillos es necesaria para generar una vibración dentro del líquido. La membrana timpánica y los huesecillos ajustan la impedancia entre las ondas sonoras del aire y las vibraciones sonoras del líquido del laberinto membranoso. Cuando no funciona la cadena de huesecillos, apenas se perciben los sonidos normales.
Atenuación del sonido mediante la contracción de los músculos estapedio y tensor del tímpano
Cuando la cadena de huesecillos transmite sonidos extraordinariamente altos, el músculo estapedio determina una amortiguación refleja del martillo y actúa como antagonista del tensor del tímpano. De esta manera, se incrementa la rigidez de la cadena de huesecillos y se reduce notablemente la conducción del sonido, sobre todo de las frecuencias más bajas. Curiosamente, este mismo mecanismo sirve para reducir la sensibilidad a la propia habla.
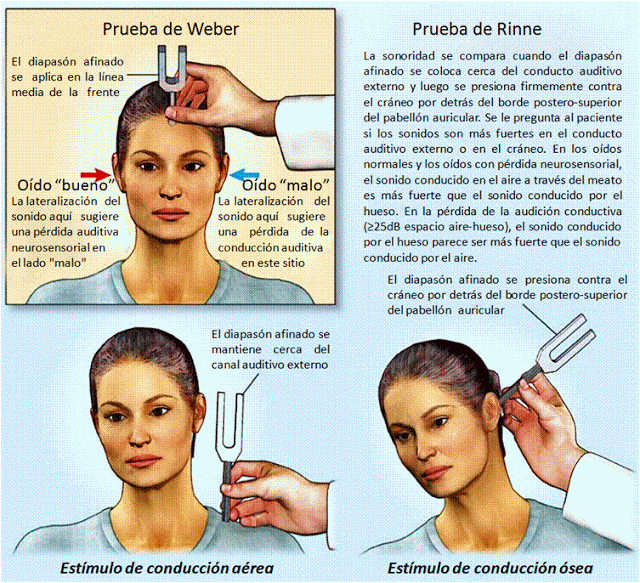
Transmisión del sonido a través del hueso (p. 634)
Como la cóclea está completamente encerrada por huesos, la vibración del cráneo puede estimular la propia cóclea. Si se hace vibrar un diapasón y se aplica sobre el cráneo, en la frente o en la apófisis mastoidea, se escucha un zumbido. En general, sin embargo, aun los sonidos relativamente altos que viajan por el aire no disponen de energía suficiente para su audición eficaz a través de la conducción ósea.
Anatomía funcional de la cóclea
La cóclea se compone de tres tubos en espiral, adosados entre sí. La rampa vestibular y la rampa media, o conducto coclear, están separadas por la membrana vestibular (membrana de Reissner), mientras que la rampa media y la rampa timpánica lo están por la membrana basilar. El órgano de Corti se encuentra en la superficie de la membrana basilar, dentro del conducto coclear. El techo del órgano de Corti lo forma la membrana tectorial. En el extremo de la cóclea, opuesto a las ventanas redonda y oval, la rampa vestibular se continúa con la timpánica por el helicotrema. La rigidez global de la membrana basilar es 100 veces menor en el helicotrema que cerca de la ventana oval, lo que significa que la porción más rígida, próxima a la ventana oval, es sensible a las vibraciones de alta frecuencia, mientras que el extremo más distensible, próximo al helicotrema, responde a las de baja frecuencia.

Transmisión de Las ondas sonoras en la cóclea: la «onda viajera
Cuando una onda sonora incide en la membrana timpánica, se ponen en movimiento los huesecillos y la base del estribo es impulsada, en la ventana oval, hacia el laberinto membranoso, generando una onda que recorre la membrana basilar hacia el helicotrema .
Los patrones de vibración son inducidos por frecuencias sonoras diferentes.
El patrón de vibración iniciado en la membrana basilar varía para cada frecuencia sonora. Cada onda es relativamente débil al principio, pero va adquiriendo más fuerza en la parte de la membrana basilar con una frecuencia resonante equivalente a la de la onda original. Esta onda muere prácticamente en este punto y no afecta al resto de la membrana basilar. Además, la velocidad de la onda que se propaga es mayor cerca de la ventana oval y va disminu- yendo gradualmente a medida que se aproxima al helicotrema.
Los patrones de vibración son inducidos por amplitudes sonoras diferentes. La amplitud máxima de vibración para una frecuencia de sonido se propaga de forma organizada la superficie de la membrana basilar. Así, la vibración máxima para un sonido con 8.000 ciclos por segundo (hercios o Hz) tiene lugar cerca de la ventana oval, mientras que para otro de 200 Hz se localiza cerca del helicotrema. El método principal de discriminación del sonido corresponde al «lugar» de máxima vibración en la membrana basilar para ese sonido.
Función del órgano de Corti
Las células receptoras del órgano de Corti son de dos tipos: células ciliadas internas y externas. Existe una única fila de células ciliadas internas en un número aproximado de 3.500, y de tres a cuatro filas de células ciliadas externas con un total aproximado de 12.000. Casi el 95% de las fibras sensitivas del octavo par craneal, que inervan la cóclea, establecen contacto sináptico con las células ciliadas internas. Los cuerpos celula- res de las fibras sensitivas se localizan en el ganglio espiral, en el modíolo (centro), que sirve de soporte de la membrana basilar en uno de sus extremos. Las prolongaciones centrales de estas células ganglionares penetran en el tronco del encéfalo, por la parte rostral del bulbo, y establecen sinapsis con los núcleos cocleares.
La vibración de la membrana basilar excita las células ciliadas. La superficie apical de las células ciliadas da origen a muchos estereocilios y a un único cinetocilio que se proyecta hacia arriba a la membrana tectoria suprayacente. Cuando vibra la membrana basilar, los cilios de la célula incluidos en la membrana tectoria se doblan en un sentido y luego en el otro; este movimiento abre mecánicamente los canales iónicos y permite que se despolarice la célula ciliada.
Los potenciales de receptor de las células ciliadas activan las fibras nerviosas auditivas. Los cerca de 100 cilios que sobresalen de la superficie apical de las células ciliadas van aumentando paulatinamente de longitud desde la zona de inserción en la membrana basilar hasta el modíolo. El más largo de estos cilios de denomina cinetocilio. Cuando los estereocilios se doblan hacia el cinetocilio, se abren los canales de potasio de la membrana ciliada, entra el potasio y se despolariza la célula. El fenómeno inverso ocurre cuando los cilios se alejan del cinetocilio; en otras palabras, la célula ciliada se híperpolariza. El líquido que baña los cilios y la superficie apical de las células ciliadas es la endolinfa. Este líquido acuoso difiere de la perilinf a de las rampas vestibular y timpánica que, al igual que el líquido extracelular, contiene mucho sodio y poco potasio. La endolinfa es segregada por la estría vascular ( epitelio especializado de la pared del conducto coclear) y posee mucho potasio y poco sodio. El potencial eléctrico a través de la endolinfa, denominado potencial endo- coclear, es de unos +80 mV. Sin embargo, el del interior de la célula ciliada es de unos -70 m V. Así pues, la diferencia potencial entre la membrana de los cilios y la cara apical de las células ciliadas se aproxima a 150 mV, lo que aumenta consi- derablernente su sensibilidad.
Vías nerviosas auditivas
Las fibras sensitivas primarias del ganglio espiral entran en el tronco del encéfalo y terminan en los núcleos cocleares dorsal y ventral. A partir de aquí se envían señales hasta el núcleo olivar superior contralateral ( e ipsolateral), cuyas células dan origen a fibras que penetran en el lemnisco lateral y terminan en el calículo inferior. Las células del colículo inferior se proyectan hacia el núcleo geniculado medial del tálamo y, desde aquí, transmiten las señales a la corteza auditiva primaria, la circunvolución temporal transversa de Heschel. Conviene saber que: 1) desde la salida de los núcleos cocleares, las señales son transmitidas bilateralmente por vías centrales, con un predominio contralateral; 2) las colaterales de las vías centrales establecen sinapsis en la formación reticular del tronco del encéfalo, y 3) las representaciones espaciales de la frecuencia sonora ( organización tonotópica) se encuen- tran en muchos niveles de las diversas agrupaciones celulares de las vías auditivas centrales.

Función de la corteza cerebral en la audición (p. 640)
La corteza auditiva primaria se corresponde con las áreas de Brodmann 41 y 42. En torno a estas áreas se sitúa el área 22, de la que forma parte la corteza auditiva secundaria.
En la corteza auditiva primaria se han descrito al menos seis representaciones tonotópicas (mapas) de la frecuencia sonora. De momento, se desconoce por qué existen diversos mapas, pero se cree que cada región selecciona algún rasgo particular del sonido o de la percepción sonora y procede a su análisis.
La destrucción bilateral de la corteza auditiva primaria no elimina la capacidad para reconocer el sonido, pero dificulta la localización del sonido ambiental. Las lesiones de la corteza auditiva secundaria entorpecen la capacidad para interpretar el significado de algunos sonidos, principalmente de las pala- bras habladas, lo que se conoce como afasia receptiva.

Determinación de la dirección de La que procede el sonido
El núcleo olivar superior se divide en medial y lateral. El subnúcleo lateral determina la dirección del sonido, al reconocer la diferencia en la intensidad sonora transmitida por los dos oídos. El subnúcleo medial localiza el sonido detectando la diferencia en el tiempo de llegada del sonido a los dos oídos. La entrada en las células de este último núcleo está segregada, de modo que las señales del oído derecho alcanzan un sistema dendrítico y las del izquierdo entablan sinapsis con otro sistema dendrítico diferente de la misma neurona.
Señales centrífugas desde el sistema nervioso central hasta los centros auditivos inferiores
Cada plano de procesamiento de la vía auditiva central da origen a fibras descendentes o retrógradas que se proyectan, de nuevo, en los núcleos cocleares y en la propia cóclea. Estas conexiones centrífugas son más acusadas en el sistema audi- tivo que en cualquier otra vía sensitiva. Se especula con la posibilidad de que estas conexiones permitan prestar una atención selectiva a determinados rasgos del sonido.
Alteraciones de la audición
Las dificultades auditivas se pueden examinar con un audímetro, que emite frecuencias sonoras específicas por separado a cada oído. Si un paciente sufre una sordera nerviosa, se afectan la transmisión aérea y ósea del sonido, y el daño suele afectar a uno o más componentes nerviosos del sistema auditivo. Si solo se afecta la transmisión aérea, la causa habitual es una lesión de la cadena de huesecillos, a menudo por una otitis media crónica .
El dolor representa, ante todo, un mecanismo protector del cuerpo, porque no es una sensibilidad pura, sino más bien la respuesta al daño tisular que se genera dentro del sistema nervioso. El dolor rápido se percibe 0,1 s después del estímulo, y el lento, 1 s o más después. El dolor lento suele asociarse con un daño tisular y puede denominarse como urente, sordo o crónico. Todos los receptores para el dolor son terminaciones nerviosas libres, cuyo número y densidad alcanza el máximo en la piel, el periostio, las paredes articulares, las superficies articulares, la duramadre y sus reflexiones dentro de la bóveda craneal .
• Los estímulos mecánicos y térmicos tienden a producir un dolor rápido.
• Los estímulos químicos suelen causar un dolor lento, pero no siempre. Algunas de las sustancias químicas que más veces producen dolor son la bradicinina, la serotonina, la histamina, los iones potasio, los ácidos, la acetilcolina y las enzimas proteolíticas. Por otro lado, las prostaglandinas y la sustancia P potencian la sensibilidad de los receptores para el dolor, pero no los excitan de forma directa.
• Los receptores para el dolor se adaptan de forma muy lenta o nula. A veces, la activación de estos receptores se va paulatinamente elevando conforme prosigue el estímulo doloroso; esto se denomina hiperalgesia.
Las señales de dolor rápido desencadenadas por estímulos mecánicos o térmicos son transmitidas por las fibras A6 de los nervios periféricos con velocidades de 6 a 30 mi s. En cambio, las señales lentas de dolor de tipo crónico se vehiculan a través de las fibras de tipo C con velocidades de 0,5 a 2 m/ s. Cuando estos dos tipos de fibras entran en la médula espinal a través de las raíces dorsales, se segregan, de tal suerte que las fibras A8 excitan fundamentalmente las neuronas de la lámina del asta dorsal y las fibras C establecen sinapsis con neuronas de la sustancia gelatinosa. Estas últimas se proyectan en la profundidad de la sustancia gris y activan fundamentalmente neuronas de la lámina V, pero también de las láminas VI y VII. Las neuronas que reciben aferencias de las fibras A8 (dolor rápido) originan el fascículo neoespinotalámico, mientras que las que reciben aferencias de las fibras C crean el fascículo paleoespinotalámico.

El fascículo neoespinotalámico sirve para localizar el dolor. La vía paleoespinotalámica es la más antigua de las dos vías del dolor, en un sentido filogenético y su actividad puede impartir una percepción desagradable del dolor.
La importancia del área somatosensitiva I en la percepción del dolor no está totalmente clara; si se extirpa por completo esta área, no desaparece la percepción del dolor, aunque estas lesiones dificulten la capacidad para interpretar la calidad del dolor y determinar su localización precisa.
Existe una enorme variabilidad en el grado de reacción de las personas a los estímulos dolorosos, en gran medida por el mecanismo que suprime el dolor (analgesia) y que reside en el sistema nervioso central. Este sistema de supresión del dolor consta de tres componentes fundamentales:
• La sustancia gris periacueductal del mesencéfalo y la de la porción rostral de la protuberancia reciben aferencias de las vías ascendentes del dolor, además de proyecciones descendentes desde el hipotálamo y otras regiones del postencéfalo.
• El núcleo magno del rafe (serotonina) y el núcleo paragigantocelular (noradrenalina) del bulbo reciben aferencias de la sustancia gris periacueductal y se proyectan hacia neuronas del asta dorsal de la médula.

• Las interneuronas encefalínicas del asta dorsal reciben aferencias de los axones descendentes serotoninérgicos del núcleo magno del rafe, que entablan contacto sináptico directo con las fibras aferentes del dolor, causando una inhibición presináptica y postsináptica de la señal de entrada. Se cree que este efecto está mediado por el bloqueo de los canales del calcio en la membrana de la terminación de la fibra sensitiva.
Las neuronas de la sustancia gris periacueductal y del núcleo magno del rafe (no las neuronas noradrenérgicas reticulares del bulbo) poseen receptores opioides en la superficie de su membrana que, cuando reciben el estímulo de un opiáceo administrado por vía exógena (analgésico) o de un neurotransmisor opioide endógeno (endorfinas y encefalinas) del cerebro, activan el circuito de supresión del dolor y reducen la percepción de este.
Casi siempre, el dolor referido se debe a señales originadas en un órgano (víscera) o en un tejido internos. El mecanismo no se conoce bien, pero se atribuye a que las fibras de dolor visceral entablan sinapsis con neuronas de la médula que también reciben aferencias de dolor de regiones cutáneas aparentemente no relacionadas con esa estimulación visceral
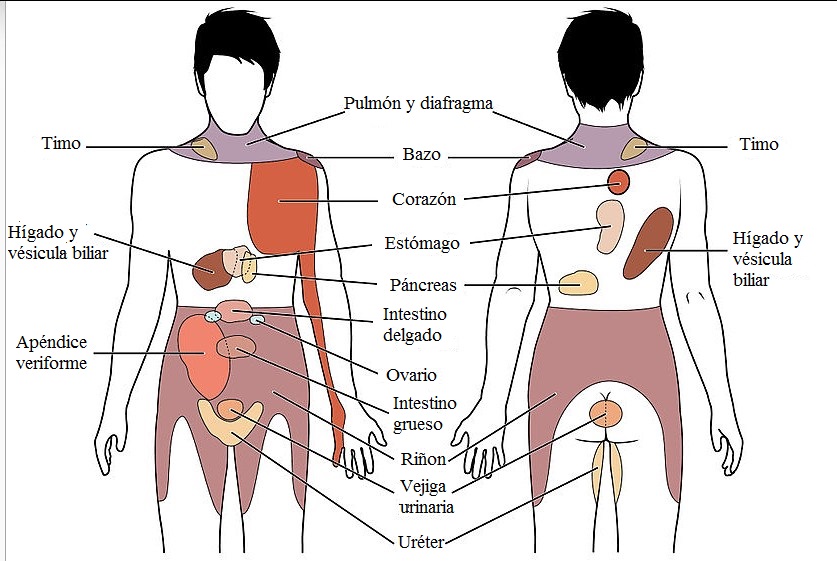
La hiperalgesia es la acentuación de la sensibilidad a los estímulos dolorosos. El umbral para la activación de los receptores del dolor y la generación subsiguiente de las señales dolorosas disminuye cuando ocurre un daño tisular local o se liberan localmente determinadas sustancias químicas
La infección por virus de un ganglio raquídeo o de un ganglio sensitivo de un nervio craneal puede producir dolor segmentario y un exantema cutáneo intenso en la zona inervada por dicho ganglio, lo que se conoce como herpes zóster (culebrilla).
El encéfalo no es sensible, por sí mismo, al dolor, pero la duramadre y las vainas de los nervios craneales contienen receptores para el dolor que transmiten las señales que circulan por los pares craneales X y XII hasta entrar en los niveles medulares C-2 y C-3. Si se dañan las estructuras sornatosensitivas, el paciente experimenta una sensación de hormigueo o acorchamiento. Las excepciones, son los tics dolorosos y el síndrome de dolor talámico.
La compresión de los senos venosos y el estiramiento de la duramadre o de los vasos sanguíneos y nervios craneales que atraviesan la duramadre produce la cefalea. Cuando se afectan las estructuras situadas por encima de la tienda del cerebelo, el dolor se refiere a la porción central de la cabeza, mientras que la lesión de las estructuras infratentoriales causa cefaleas occipitales. La inflamación meníngea ocasiona, de modo característico, un dolor en toda la cabeza. De la misma manera, si se extrae una pequeña cantidad de líquido cefalorraquídeo (incluso 20 ml) y el paciente no está tumbado, la gravedad hace que el cerebro se «hunda», lo que da lugar a un estiramiento de las meninges, los vasos sanguíneos y los pares craneales, lo que origina una cefalea difusa. Se cree que la cefalea que sigue a una borrachera está causada por la irritación tóxica directa del alcohol sobre las meninges. El estreñimiento también puede producir cefalea por los efectos tóxicos directos de sustancias metabólicas circulantes o por cambios circulatorios asociados a las pérdidas intestinales de líquido.
La tensión emocional puede hacer que los músculos de la cabeza, sobre todo aquellos que se insertan en el cuero cabelludo y en el cuello, se tornen espásticos e irriten los puntos de inserción. La irritación de las estructuras nasales y paranasales de la nariz, extraordinariamente sensibles, explicarían la cefalea sinusal. La dificultad para el enfoque ocular da lugar a una contracción excesiva del músculo ciliar y de los músculos de la cara, en su esfuerzo por agudizar el foco sobre el objeto en cuestión. Se produce así un dolor ocular y facial que suele conocerse como cefalea por esfuerzo ocular.
• Los receptores para el dolor solo se estimulan con el frío o el calor extremos y, en estos casos, se percibe una sensación de dolor y no térmica.
• Los receptores específicos para el calor todavía no se conocen, pero se ha propuesto su existencia en los experimentos psicofísicos; por el momento, se consideran meramente terminaciones nerviosas libres. Las señales de calor son transmitidas por fibras sensitivas de tipo C.
• El receptor para el frío se ha reconocido como una pequeña terminación nerviosa, cuyos extremos sobresalen en la cara basal de las células basales de la epidermis. Las señales de estos receptores son transmitidas por fibras sensitivas de tipo A6. El número de receptores para el frío es de 3 a 10 mayor que los del calor, y su densidad varía entre 15 y 25 por cm2 en los labios, y entre 3 y 5 por cm2 en los dedos de la mano.
Las temperaturas inferiores a 7 ºC y las superiores a 50 ºC activan los receptores para el dolor; estos dos extremos se perciben de manera análoga como un dolor intenso, y no como frío o calor. La temperatura máxima de activación de los receptores para el frío se aproxima a los 24 ºC, y la del calor, a unos 45 ºC. Tanto los receptores para el frío como para el calor se estimulan con temperaturas situadas en el intervalo de 31 a 43 ºC.
los receptores para el frío y el calor responden a la temperatura estacionaria y a los cambios de temperatura. Así se explica por qué una temperatura exterior fría se «percibe» mucho más fría al principio si uno viene de un entorno caliente. El mecanismo estimulador de los receptores térmicos está relacionado, al parecer, con el cambio en el metabolismo de la fibra nerviosa inducido por la variación de temperatura. Se ha comprobado que, con cada variación de la temperatura de 10 ºC, la velocidad de las reacciones químicas intracelulares experimenta un cambio doble.
La densidad de los receptores térmicos en la superficie de la piel es bastante pequeña, por lo que las variaciones de temperatura, si afligen solo a una pequeña región, no se detectan con la misma eficacia que aquellas que actúan sobre una superficie amplia. Si se estimula todo el cuerpo, pueden detectarse cambios térmicos tan pequeños como 0,01 ºC. Las señales térmicas son transmitidas al sistema nervioso central en paralelo con las del dolor.
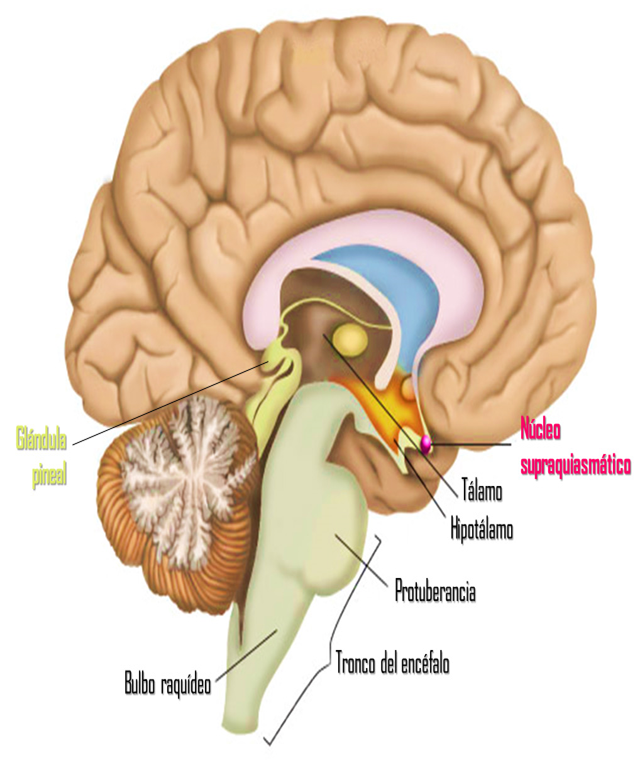
Los axones de las células ganglionares de la retina forman el nervio óptico. Los axones que se originan en la mitad nasal de la retina se decusan por el quiasma óptico y los de la mitad temporal continúan por la cara lateral del quiasma sin cruzarse. Los axones retinianos siguen detrás del quiasma en forma de tracto óptico y la mayoría termina en el núcleo geniculado lateral dorsal. Desde aquí, los axones de las neuronas geniculadas siguen discurriendo en sentido posterior en forma de radiaciones geniculocalcarínas (ópticas) y acaban en la corteza visual (estriada) primaria. Además, los axones de la retina se propagan a otras regiones del encéfalo como:
1) el núcleo supraquiasmático (control del ritmo circadiano)
2) los núcleos pretectales (reflejos fotomotores pupilares)
3) el calículo superior (control de los movimientos oculares rápidos)
4) el núcleo geniculado lateral ventral
Ese núcleo es una estructura laminar que consta de seis capas concéntricas. La más interna es la capa I, y la más superficial, la capa VI. Los axones de la retina que terminan en este núcleo provienen de la retina nasal contralateral y de la retina temporal ipsolateral, y transportan, en consecuencia, una información punto a punto del campo visual contralateral. Las fibras nasales contralaterales terminan en las capas I, N y VI, y las fibras temporales ipsolaterales, en las capas II, III y V. La información de ambos ojos sigue segregada en el núcleo geniculado lateral dorsal, al igual que las señales provenientes de las células ganglionares X e Y de la retina. La entrada de las células Y termina en las capas I y II, que se denominan capas magnocelulares porque contienen neuronas bastante grandes. Esta es una vía de conducción rápida, con ceguera para los colores, pero con una información localizadora eficaz. Las capas III a VI se denominan parvocelulares porque contienen neuronas bastante pequeñas que reciben señales de las células X, que transmiten información del color y de la forma. Por tanto, la información de la retina se procesa a lo largo de al menos dos vías paralelas:
1) una corriente dorsal que transporta información de los bastones y las grandes células ganglionares (Y) que dan información específica de la localización y del movimiento.
2) una corriente ventral que transporta información del color y la forma desde los conos y las pequeñas células ganglionares.

La corteza visual primaria, o área 17 de Brodmann, también se denomina V-1. Está localizada en la cara medial del hemisferio y reviste las dos paredes del surco calcarino, cerca del polo occipital. Recibe señales visuales de cada ojo y contiene la representación de todo el campo visual contralateral: el campo visual inferior está contenido en el banco superior del surco calcarino, y el superior, en el inferior. La porción macular de la retina se representa posteriormente, cerca del polo occipital, y las señales de la retina más periférica alcanzan los territorios mas anteriores.
Como todas las demás áreas de la neocorteza, la corteza visual primaria se organiza en seis capas horizontales. Las fibras geniculadas de entrada, de tipo Y, terminan, principalmente, en una subdivisión de la capa IV denominada IVca, mientras que las de tipo X terminan principalmente en las capas IVa y IV c{3.
La corteza visual secundaría (denominada V- 2 a V-5) rodea el área primaria y se corresponde con.las áreas 18 y 19 de Brodmann, con la circunvolución temporal media (TM) y con las áreas 7a y 37 de Brodmann.
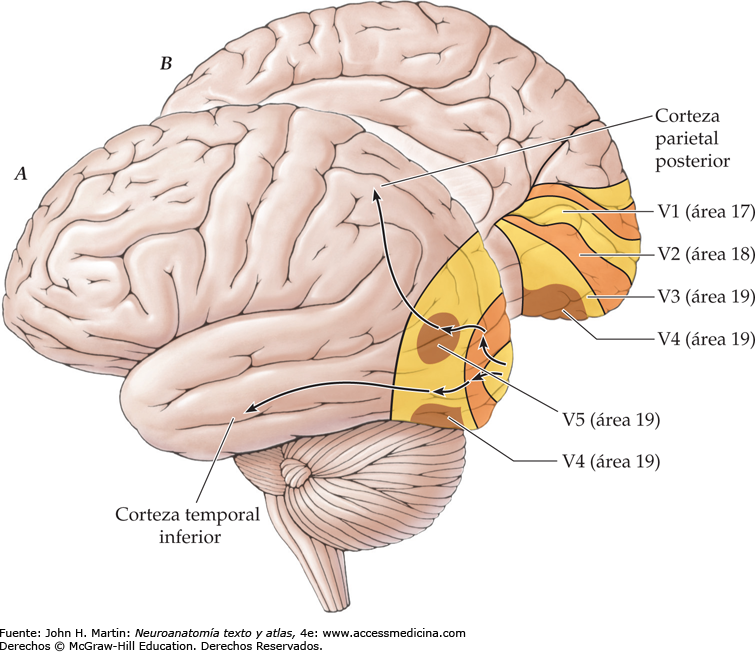
Manchas de color
Estos agregados neuronales responden de manera específica a las señales de color mediadas por las columnas corticales circundantes.
Las células de una columna vertical de la capa IV son las responsables principales de las aferencias de un ojo, y las neuronas de la siguiente columna adyacente responden de preferencia al otro ojo. Estas son las denominadas columnas de dominancia ocular.
Las relaciones neuronales de la vía de las células Y siguen una corriente más dorsal desde V-1 hasta el área rostral adyacente 18 (V-2) y, después, hasta la corteza parietal. Esta vía señaliza el «lugar de origen» del estímulo y transporta una inforrnación localizadora precisa de la imagen visual en el espacio, la forma aproximada de la imagen y su posible movimiento. Por el contrario, la vía más ventral, desde V-1 hasta el área V-2 adyacente, y la corteza de la asociación temporal transportan la información de las células X necesaria para el análisis de los detalles visuales. Estas señales se utilizan para reconocer las texturas, las letras y las palabras, así como el color de los objetos; por tanto, determinan «en qué» consiste el objeto y su significado.
Una de las funciones primordiales del sistema visual es detectar el contraste, principalmente los bordes formados por líneas. Las neuronas de la capa IV de V-1, denominadas células simples, son las principales responsables de que las líneas o los bordes se alineen con una orientación preferida.
Otras células de V-1, llamadas células complejas) hacen que las líneas o bordes adopten una orientación preferida, aunque dicha línea pueda desplazarse lateral o verticalmente en una distancia determinada.
Una tercera clase de célula, denominada hipercompleja, está localizada, principalmente, en las áreas de asociación visual. Estas células detectan las líneas o bordes con una longitud concreta, una forma angulada específica o un rasgo relativamente complejo.

El color se detecta por medio del contraste. A menudo, el color contrasta con una porción blanca de la escena, que es la base del concepto de constancia del color expuesto El contraste del color se detecta mediante un proceso antagónico, en el que ciertos colores excitan determinadas neuronas e inhiben otras.
La extirpación de V-1 determina una pérdida de la visión consciente. Las personas pueden seguir reaccionando de forma «reflexiva» a los cambios en la intensidad de la luz, los movimientos en la escena visual y los patrones generales de estimulación lumínica. Esta actividad se debe, fundamentalmente, a los centros visuales subcorticales, como los colículos superiores.
El campo visual el área vista por un ojo se divide en una porción nasal (medial) y otra temporal (lateral). La exploración del campo visual de cada ojo por separado se conoce como campimetria. El sujeto se fija en un solo punto del centro del campo visual, mientras un segundo punto pequeño entra y sale de dicho campo. Después, el sujeto debe precisar su localización .
En la parte del campo visual ocupada por el disco óptico existe una mancha ciega. Cualquier mancha ciega en otra porción del campo visual se denomina escotoma. En la retinitis pigmentaria degeneran partes de la retina y se deposita, en estas zonas, una cantidad excesiva del pigmento melanina. Este proceso suele iniciarse en la retina periférica y luego se propaga centralmente.

La lesión de las radiaciones ópticas de un hemisferio produce un defecto similar. Estas dos lesiones se diferencian por la presencia o ausencia de los reflejos fotomotores pupilares. Si los reflejos se preservan, la lesión se encuentra en las radiaciones ópticas; si están abolidos, la lesión debe afectar los tractos ópticos que vehiculan las señales de la retina hasta la región pretectal.
Para que se interprete de manera correcta una escena visual, el cerebro debe desplazar los ojos hasta una posición en que dicha escena se contemple adecuadamente. El movimiento ocular se debe a tres pares de músculos: los rectos medial y lateral, los rectos superior e inferior y los oblicuos superior e inferior. Estos músculos están inervados por motoneuronas de los núcleos de los pares craneales tercero, cuarto y sexto. La actividad de estas motoneuronas depende de diversas áreas del encéfalo, entre ellas las células de los lóbulos frontal, parietal y occipital; la formación reticular del tronco del encéfalo; el colículo superior; el cerebelo; y los núcleos vestibulares. Se consideran tres categorías generales de movimientos oculares: movimientos de fijación, movimientos sacádicos y movimientos de seguimiento.
La fijación consiste en mover los ojos para que una parte concreta del campo visual sea enfocada en la fóvea. La fijación voluntaria está controlada por los campos oculares frontales, el área 8 de Brodmann y un área del lóbulo occipital que representa parte de la corteza visual secundaria (área 19).

Los movimientos sacádicos de los ojos constituyen un mecanismo formado por puntos sucesivos de fijación. Cuando los ojos saltan rápidamente de un objeto a otro, cada salto representa una sacudida. Estos movimientos son rápidos y el cerebro suprime la imagen visual durante el movimiento, por lo que, de ordinario, no se tiene conciencia del movimiento de un punto a otro.
Los movimientos de seguimiento ocurren con la fijación ocular de objetos en movimiento. El sistema regulador de estos movimientos depende de la transmisión de la información visual hasta el cerebelo por diversas vías. Después, el cerebro activa la trayectoria del objeto y las motoneuronas correspondientes desplazan los ojos para que el objeto se mantenga enfocado en la fóvea.

Los colículos superiores son los principales responsables de la orientación de los ojos y de la cabeza hacia un estímulo visual (o auditivo). El campo visual se cartografía en el calículo superior de forma independiente al mapa similar creado en la corteza visual. Se piensa que esta actividad está mediada por señales provenientes de las células ganglionares Y de la retina (y quizá también de las células W). El colículo superior también hace que la cabeza y el cuerpo giren hacia el estímulo visual a través de sus proyecciones descendentes por el fascículo tectoespinal. El calículo superior cumple una misión integradora global con relación a la orientación de los ojos y del cuerpo hacia diversos estímulos.
Las fibras parasimpáticas dirigidas al ojo se originan en el núcleo de Edinger-W estphal y discurren por el nervio motor ocular común hasta el ganglio ciliar, donde nacen las fibras posganglionares que llegan al ojo con los nervios ciliares. Las fibras simpáticas se originan en la columna intermediolateral de la médula y pasan al ganglio cervical superior. Las fibras simpáticas posganglionares viajan con la arteria carótida interna y oftálmica hasta alcanzar finalmente el ojo.
Si se modifica el punto de fijación ocular, el poder de enfoque del cristalino se adapta en la dirección adecuada mediante la activación pertinente· de la inervación autónoma de los músculos ciliar y esfínter de la pupila de cada ojo. Cuando los ojos cambian el enfoque de un objeto lejano a otro cercano (o viceversa), deben necesariamente converger, para lo que se precisa la activación bilateral de los músculos rectos mediales de cada ojo. Las áreas del encéfalo que regulan los cambios pupilares y la convergencia están suficientemente separadas, puesto que las lesiones alteran una función, pero no la otra. Así, la pupila de Argyll-Robertson es aquella que no muestra reflejos fotomotores normales, pero sí de acomodación. Este tipo de pupila se observa con frecuencia entre las personas aquejadas de sífilis.

La retina se compone de 10 capas o estratos celulares:
La fóvea es una región especializada, de aproximadamente 1 mm, situada en el centro de la retina. Dentro del centro de la fóvea existe una zona, denominada fóvea central, con un diámetro de 0,3 mm; esta es la región donde la agudeza visual alcanza el máximo y la capa de fotorreceptores solo contiene conos.

Cada fotorreceptor se compone de:
Los receptores se denominan bastones o conos, dependiendo, principalmente, de la forma del segmento externo.
El fotopigmento sensible a la luz rodopsina se localiza en el segmento externo del bastón, mientras que el del cono contiene un material parecido, un pigmento sensible a los colores, la fotopsina. Estos fotopigmentos son proteínas incorporadas a un conjunto apilado de discos membranosos en el segmento externo del receptor, que representa un repliegue de la membrana celular externa.
Los segmentos internos de los bastones y conos son básicamente idénticos y contienen componentes y orgánulos citoplásmicos comunes a otros somas neuronales. Cada núcleo del fotorreceptor se continúa con su propio segmento interno, pero la membrana limitante externa de la retina establece una separación o frontera incompleta entre la capa de los segmentos internos y la capa de los núcleos fotorreceptores (capa nuclear externa).

El cuerpo sináptico contiene elementos como mitocondrias y vesículas sinápticas, habituales en las terminaciones axónicas del cerebro. El pigmento negro melanina de la capa de pigmento reduce la reflexión de la luz por el globo ocular y cumple, por tanto, una función parecida al color negro del interior de los fuelles de una cámara. La importancia de este pigmento se reconoce mejor por su ausencia en las personas albinas. Los albinos casi nunca alcanzan una agudeza visual mayor de 20/100 debido a la enorme reflexión que tiene lugar dentro del globo ocular. La capa de pigmento también almacena grandes cantidades de vitamina A, empleadas en la síntesis de los pigmentos visuales.
La rodopsina se descompone por la energía lumínica. El fotopigmento rodopsina de los bastones se concentra en la porción del segmento externo que sobresale hacia la capa pigmentaria. Esta sustancia es una combinación de la proteína escotopsína y del pigmento carotenoide retinal o, más concretamente, 11-cis retinal. Cuando la rodopsina absorbe la energía lumínica, el retina! se transforma en su configuración todo-trans y comienzan a separarse los componentes retinal y escotopsina. Tras una serie de reacciones extraordinariamente rápidas, el componente retinal se transforma en lumirrodopsina, metarrodopsina I, metarrodopsina II y, por último, escotopsina; y se escinde el todo-trans retinal, Durante este proceso, se cree que la metarrodopsina II se ocupa de la transmisión de los impulsos sucesivos por la retina.
Regeneración de la rodopsina.
En la primera etapa de regeneración de la rodopsina, el todo-trans retinal se convierte en 11-cis retinal, que se combina en seguida con la escotopsina para dar la rodopsina. Existe una segunda vía de formación de la rodopsina basada en la conversión del todo- trans retinal en todo-trans retinol, una forma de vitamina A. El retinol se convierte por vía enzimática en 11-cis retinol y luego en 11-cis retínal, que puede combinarse con la escotopsina para dar rodopsina. Si la retina contiene un exceso de retinal, se transforma en vitamina A, disminuyendo así la cantidad total de rodopsina de la retina.
Los bastones siguen un comportamiento muy distinto a otros receptores neurales. En la oscuridad (sin ninguna estimulación lumínica), las membranas del segmento externo de los bastones son «permeables» al sodio, es decir, los iones sodio entran en el segmento externo y cambian el potencial de membrana desde el valor característico de – 70 a -80 m V, hallado en los receptores sensitivos, hasta un valor más positivo de -40 mV. Esta se denomina corriente de sodio o «corriente oscura>> y hace que se libere una pequeña cantidad de transmisor en la oscuridad. Cuando la luz incide en el segmento externo del bastón, las moléculas de rodopsina experimentan la serie de reacciones expuesta con anterioridad, lo que reduce la conductancia del sodio por el segmento externo y también la corriente oscura. Algunos iones sodio siguen siendo bombeados fuera de la membrana celular y la pérdida de estos iones positivos hace que el interior de la célula se torne más negativo; el potencial de membrana se hace más negativo, es decir, se hiperpolariza. Se detiene entonces el flujo del transmisor.
Cuando la luz incide sobre un fotorreceptor, la hiperpolarización pasajera de los bastones alcanza el máximo en unos 0,3 s y dura más de 1 s. Además, la magnitud del potencial de receptor es proporcional al logaritmo de la intensidad lumínica. Este hecho reviste enorme significado funcional, porque permite que el ojo discrimine la intensidad lumínica en un intervalo muchos miles de veces superior al teórico. Todo ello es consecuencia de una cascada química extremadamente sensible que multiplica casi un millón de veces los efectos estimuladores de la siguiente manera. La rodopsina activada (metarrodopsina II) actúa, a modo de enzima, activando numerosas moléculas de transducina, una proteína que se encuentra también en la membrana de los discos del segmento externo. La transducina activada activa, a su vez, la fosfodiesterasa, enzima que hidroliza de inmediato múltiples moléculas de monofosfato de guanosina cíclico (GMPc). Esta pérdida de GMPc hace que se cierren muchos canales de sodio, con lo que el potencial de membrana se va volviendo cada vez más negativo (hiperpolarizado). En el plazo de 1 s, la metarrodopsina ll se inactiva y toda la cascada revierte: el potencial de membrana se torna más despolarizado a medida que se vuelven a abrir los canales de sodio, y el sodio, una vez más, penetra en el segmento externo al restablecerse la corriente oscura. Los conos se comportan de forma parecida, pero el factor de amplificación es entre 30 y 300 veces menor que el de los bastones. La opsina de los conos se denomina fotopsina; y su composición química es distinta a la de la rodopsina, mientras que el componente retinal es exactamente el mismo que el de los bastones. Existen tres tipos de conos, caracterizados cada uno por una fotopsina diferente con una sensibilidad máxima a una longitud de onda determinada de la luz, en la porción azul, verde o roja del espectro lumínico.

Si se efectúa una exposición prolongada a una luz brillante, un porcentaje considerable de las sustancias fotoquímicas de los bastones y de los conos disminuye y gran parte del retinal se transforma en vitamina A. El resultado es un descenso de la sensibilidad global a la luz, que se conoce como adaptación a la luz. Por el contrario, si una persona permanece mucho tiempo en la oscuridad, las opsinas y el retinal se convierten de nuevo en pigmentos fotosensibles. Además, la vitamina A se transforma en retinal, aportando aún más pigmento fotosensible; este proceso se denomina adaptación a la oscuridad y tiene lugar cuatro veces más deprisa en los conos que en los bastones, pese a que los primeros resulten menos sensibles a la oscuridad. Los conos cesan de adaptarse a los pocos minutos, mientras que los bastones, con una adaptación más lenta, continúan haciéndolo durante minutos u horas, y su sensibilidad aumenta dentro de un amplio espectro.
La adaptación puede ocurrir, asimismo, a través de cambios del tamaño pupilar, que puede variar del orden de 30 veces en una fracción de segundo. Los circuitos existentes dentro de la retina y del cerebro también presentan una adaptación neural. Cuando aumenta la intensidad lumínica, también lo hace la transmisión desde la célula bipolar hasta la célula horizontal, la célula amacrina y la célula ganglionar. A pesar de que esta última adaptación es menos potente que los cambios pupilares, la adaptación neural, como la pupilar, ocurre con rapidez.
La utilidad de la adaptación a la luz y a la oscuridad permite que el ojo experimente cambios de sensibilidad por factores de hasta 500.000 a 1 millón, como se reconoce cuando, desde un ambiente muy iluminado, se pasa a una sala oscura. La sensibilidad de la retina es baja, porque está adaptada a la luz y en una habitación oscura se ve poco. Cuando se produce la adaptación a la oscuridad, mejora la visión en esas condiciones. Se cree que la intensidad de la luz solar es 10.000 millones de veces mayor que la intensidad de la luz en una noche estrellada. Sin embargo, el ojo puede operar, hasta cierto punto, en ambas condiciones, debido a su enorme margen de adaptación.
La sensibilidad espectral de los tres tipos de conos depende de las curvas de absorción de la luz de los tres pigmentos respectivos. Todo el color visible (aparte del azul, verde o rojo) es el resultado de la estimulación combinada de dos o más tipos de conos. El sistema nervioso interpreta como color la relación entre la actividad de los tres tipos. Se interpreta como luz blanca una estirnulación equivalente de los conos azules, verdes y rojos.
Si se modifica el color de la luz que ilumina una escena, no se altera sustancialmente la tonalidad del color de esa escena, lo que se conoce como constancia del color, mecanismo atribuido a la corteza visual primaria.
Cuando falta un tipo concreto de cono de la retina, no se logran distinguir ciertos colores. Una persona sin conos rojos sufre protanopia. El espectro global se acorta por el extremo largo de la longitud de onda cuando faltan los conos rojos. La ceguera para los colores rojo y verde es un defecto genético de los hombres transmitido por las mujeres. Los genes del cromosoma X femenino codifican los conos respectivos.
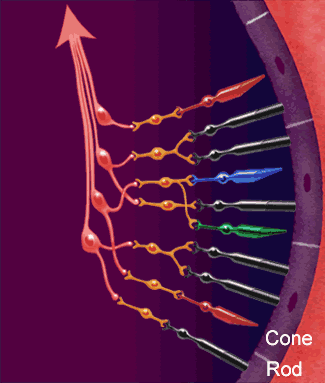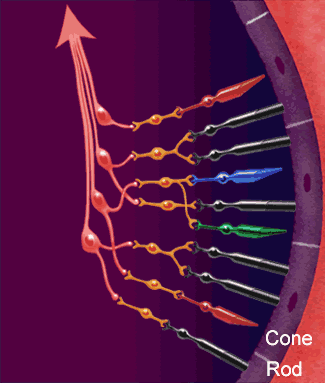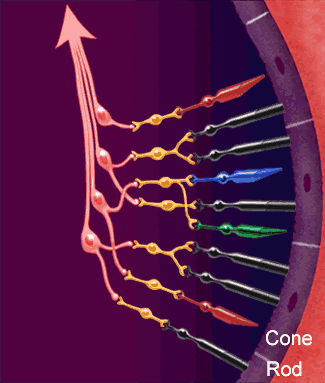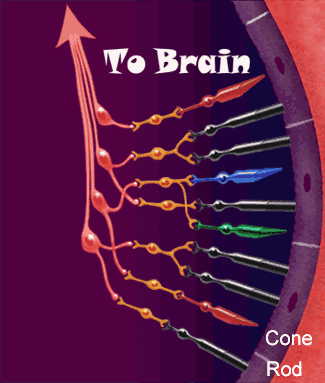
Los neurotransmisores presentes en la retina son:
A partir de los fotorreceptores, las señales se transmiten hasta la capa de células ganglionares exclusivamente por conducción electrotónica (potenciales graduados) y no mediante potenciales de acción. La célula ganglionar es la única neurona de la retina capaz de generar un potencial de acción; así se garantiza que las señales de la retina reflejen exactamente la intensidad lumínica, y ello confiere una mayor flexibilidad a las normas de la retina en su respuesta.
Las prolongaciones de las células horizontales conectan lateralmente con los cuerpos sinápticos de los fotorreceptores y las dendritas de las células bipolares. Los fotorreceptores situados en el centro de un haz de luz reciben la estimulación máxima, mientras que los periféricos son inactivados por las células horizontales, que, a su vez, se activan por el haz luminoso. Se dice que el entorno se inhibe, mientras que la región central se excita ( aunque quizá estos términos no sean precisamente adecuados). Esta es la base de la potenciación del contraste visual. Las células amacrinas también pueden contribuir a potenciar el contraste a través de sus proyecciones laterales hacia la capa plexiforme interna. Curiosamente, mientras que algunas células horizontales poseen axones, las células amacrinas no y, en consecuencia, sus propiedades fisiológicas son extraordinariamente complejas.
Algunas células bipolares se despolarizan cuando la luz estimula sus fotorreceptores o receptores asociados, mientras que otras se hiperpolarizan, dos células bipolares responden simplemente de modo distinto a la liberación de glutamato por el receptor; la primera se excita con el glutamato y la segunda se inhibe. La segunda explicación es que un tipo de célula bipolar recibiría aferencias (excitadoras) directas del fotorreceptor y el otro aferencias inhibidoras indirectas de una célula horizontal. La excitación de algunas células bipolares y la inhibición de otras podrían, asimismo, contribuir al esquema de inhibición lateral.
Se han identificado unas 30 clases de células amacrinas. Algunas responden enérgicamente al comienzo de la estimulación visual, otras al apagado y otras a la iluminación y al apagado. Existe un tipo celular que solo responde a los estímulos en movimiento. Dada la variedad de neurotransmisores empleados por esta categoría de células, no puede efectuarse ninguna generalización en cuanto a su efecto sobre la neurona efectora.
La población de las células ganglionares se divide en las categorías W, X e Y.
Las fibras del nervio óptico están formadas por axones de las células ganglionares. Aun cuando no sean estimuladas, estas células transmiten potenciales de acción con velocidades que oscilan entre 5 y 40 por segundo. Así pues, las señales visuales se superponen a esta descarga de fondo o espontánea.
Muchas células ganglionares son particularmente sensibles a los cambios en la intensidad de la luz. Algunas responden con una mayor descarga cuando se acentúa la intensidad lumínica y otras incrementan la descarga al reducirse la intensidad de la luz. Estos efectos obedecen a la presencia de células bipolares despolarizantes e hiperpolarizantes. La capacidad de respuesta a la fluctuación en la intensidad lumínica también está muy desarrollada en las regiones periféricas y foveal de la retina.
Se dice que las células ganglionares responden a los límites del contraste más que al valor absoluto de iluminación. Cuando una luz difusa y plana activa los fotorreceptores, las células bipolares despolarizantes proporcionan una salida excitadora, pero las hiperpolarizantes y las células horizontales generan una salida inhibitoria simultánea. Cuando un estímulo luminoso posee un contraste nítido, en el límite entre luz y oscuridad, se hiperpolariza un fotorreceptor de la zona iluminada y se transmite, a través de esa célula bipolar, una señal despolarizante hasta una célula ganglionar que empieza a descargar con más frecuencia. El fotorreceptor vecino de la región oscura se despolariza y se inactiva la línea célula bipolarganglionar. Simultáneamente, una célula horizontal relacionada con el fotorreceptor hiperpolarizado (iluminado) se inactiva porque el fotorreceptor deja de liberar la sustancia transmisora que despolariza la célula horizontal. Así pues, la influencia hiperpolarizante ejercida por esta célula horizontal sobre el fotorreceptor vecino (despolarizado) de la zona oscura desaparece, con lo que el fotorreceptor se despolariza todavía más. La zona oscura se vuelve «más oscura» y la zona de luz se torna «más iluminada» ( es decir, se potencia el contraste).
Algunas células ganglionares son estimuladas por los tres tipos de conos. Se cree que estas células ganglionares emiten una señal luminosa «blanca». Sin embargo, la mayoría de las células ganglionares son estimuladas por la luz de una longitud de onda e inhibidas por otra. Así, la luz roja puede excitar una determinada célula ganglionar, y la verde, inhibirla; este es el mecanismo oponente del color y se atribuye al proceso empleado para discriminar los colores. Como el sustrato de este proceso está presente en la retina, el reconocimiento y la percepción del color pueden comenzar, de hecho, en la retina en el elemento receptor sensitivo primario .